核药“下一程”
来源:医药魔方 2025-07-01 14:42
以Pluvicto为代表的靶向放射性核素疗法(Targeted Radionuclide Therapy,TRT,也称靶向核药、放射性配体疗法、RDC等)在临床疗效及商业化方面的双重成功让核药成为了过去两三年最炙手可热的赛道之一。
TRT一般包含四部分:放射性同位素、螯合剂(负责稳定或“笼化”放射性核素,以防止核素在到达目的地之前伤及无辜)、靶向配体(负责精准识别和结合肿瘤靶点)及连接子(linker,负责连接靶向配体和螯合剂)。
在TRT领域,诺华是目前当之无愧的领导者,已有两款基于β核素(Lu-177)的TRT(Lutathera、Pluvicto)获批上市。Lutathera靶向SSTR,于2017年9月获欧盟批准,治疗胃肠胰神经内分泌肿瘤,2018年1月在美国获批上市;Pluvicto靶向PSMA,于2022年3月获FDA批准用于治疗转移性去势抵抗前列腺癌。2024年(上市第3年),Pluvicto销售额突破10亿美元(13.92亿美元),正式跻身“重磅炸弹药物”俱乐部。
过去两三年,制药巨头们加速布局TRT赛道。诺华、礼来、BMS、阿斯利康、赛诺菲等巨头纷纷通过收购或合作“争夺”高潜力核药管线或公司。细看这些交易,基于α核素开发下一代靶向核药大势所趋。
与β核素相比,α核素具有更高的能量和更短的穿透距离,这可能转化为更好的功效,同时最大限度地减少脱靶毒性。基于这些潜在的优势,很多制药公司及Biotech开始大力布局基于Pb-212, At-211和Ac-225的下一代靶向核药。一些代表性项目已经取得了令人振奋的进展,例如RadioMedix的候选药物AlphaMedix(基于Pb-212,靶向SSTR)使得大约55%的患者晚期神经内分泌肿瘤缩小;许多患者不再有疾病迹象。AlphaMedix当前处于II期临床开发阶段(NCT05153772),曾在2024年5月获得FDA授予的突破性疗法认定(BTD),治疗胃肠胰神经内分泌肿瘤(首个获得BTD的α核素靶向核药)。同年9月,赛诺菲获得了AlphaMedix的全球商业化授权,交易首付款1亿欧元,销售里程金2.2亿欧元。
药物研发人员希望,α核素靶向核药的应用能够拓展到更多癌症类型,如肝细胞癌、肺癌、黑色素瘤等等。
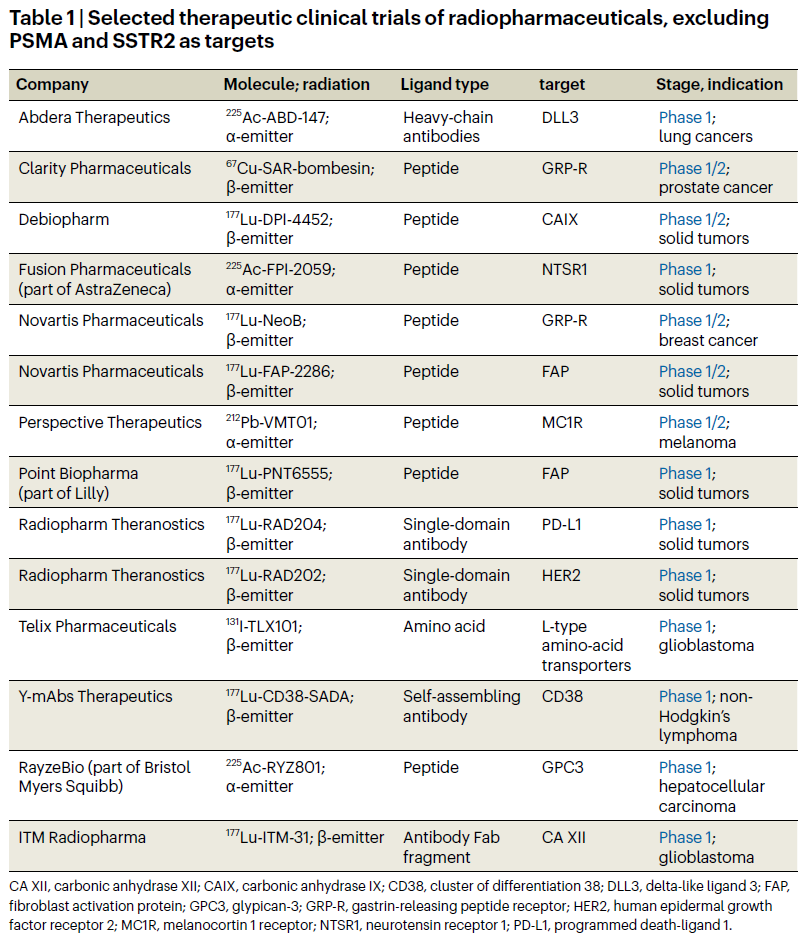
来源:Nature Biotechnology;发表时间:2025-05-16
靶向核药中递送放射性核素的配体目前以肽为主。多肽的优势在于,其全身半衰期短、可通过肾脏快速清除。目前,制药公司及Biotech正在开发新结构的肽。举例来说,Bicycle Therapeutics开发合成双环肽作为靶向配体,其基于双环肽的PDC项目已经进入II/III期临床,目前正在加速开发基于双环肽的靶向核药。
2024年5月,北京大学刘志博教授团队及其合作者在一篇Nature论文中提出了一种创新策略,将递送放射性同位素的肽锁定在其靶点上,从而“限定”在肿瘤部位。具体来说,团队开发了一种共价靶向放射性配体(covalent targeted radioligand,CTR),这是一种三功能偶联物,在传统放射性配体分子的合适位置连接了一个基于硫(Ⅵ)-氟交换反应(SuFEx)的共价“弹头”。当CTR到达肿瘤时,先非共价地与靶点结合,随后通过邻近效应进行不可逆的共价结合,以防止被快速清除。未结合靶点的游离CTR将被快速排出,从而限制了全身毒性的风险。
作为概念验证,研究人员选择了成纤维细胞激活蛋白(FAP)作为开发CTR的靶点。结果显示,在小鼠中,与非共价配体相比,CTR导致靶向核药的肿瘤摄取增加了2.5倍。在两例癌症患者中,基于CTR开发的靶向核药发现了更多的可疑病变。
抗体也能以精确的特异性递送放射性核素,但其可以在体内停留数周,当与放射性核素结合时,可能会在骨髓中沉积辐射并引起血液毒性。因此,多个公司在寻找更好的替代方案,如使用抗体片段、DARPins、mini-proteins。
DARPins全称为the designed ankyrin repeat proteins,可以识别各种靶点。Molecular Partners正在基于DARPins开发靶向核药,一个靶向细胞表面间皮素的候选分子正在进行临床前研究;另一个靶向DLL-3的候选分子(递送Pb-212)预计将于今年开始用于小细胞肺癌的首次人体研究。
其他一些公司设计了抗体的功能单元,其结合了小肽的优势(高溶解度和肿瘤穿透性)与传统单抗的特异性。Precirix是最早产生临床数据的Biotech公司之一。这家公司以靶向HER2的纳米抗体(nanobodies,单域抗体)递送碘-131,其单域抗体可以结合靶点,并在肿瘤细胞上停留7天以上,未结合的放射性核素在数小时内被肾脏迅速清除。Precirix进展较快的管线靶向FAP,递送α核素。
也有公司在利用全长抗体来递送放射性同位素,Tagworks是其中一员,该公司认为全长单抗具有高亲和力、良好的肿瘤暴露和低肾脏暴露。公司的点击释放(click-to-release)技术使用可切割linker将同位素附着在靶向分子上(全长抗体)。一旦药物被注入患者体内,抗体与其靶点结合,一种四嗪分子就会被注入,它使用点击化学释放同位素。然后,这些同位素会很快从体内清除。由于四嗪分子无法渗透到细胞内,所以它不会影响已经内化进入肿瘤细胞的抗体-核素偶联物。据称,首次人体试验预计将于今年晚些时候开始(以HER2为靶点)。
Y-mAbs、罗氏以及OncoOne等公司正在探索相反的途径:患者首先接受未标记抗体或自组装抗体,这些抗体会附着在肿瘤上,未结合靶点的抗体会通过血液被清除。然而,给患者注射放射性示踪剂,示踪剂通过点击化学或双特异性抗体相互作用与预先附着在肿瘤上的抗体结合。未结合的示踪剂被迅速清除。一项成像试验正在测试这种策略,利用抗体预靶向(pre-targeting)胰腺癌细胞上的CA19-9。Y-mAbs的相关项目已经进入I期临床,使用自组装抗体片段靶向非霍奇金淋巴瘤靶点CD38,递送Lu-177。Orano Med也在和罗氏合作,开发预靶向策略。
当前,医生、投资者、Biotech公司、制药巨头都将目光投向靶向核药领域,在该领域的大规模投资无疑将推动该赛道的进一步创新。在Lutathera和Pluvicto作为“TRT先锋”推出之后,靶向核药正在开辟更广阔的天地。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


